Des structures auto-assemblables de protéines artificielles ou comment élaborer un « origami » moléculaire
Quatre équipes de recherche françaises démontrent la possibilité de construire des architectures supramoléculaires ordonnées qui se forment spontanément à partir de protéines spécialement conçues dans ce but. La clé de cette innovation est l'ingénierie de protéines très régulières, à motifs répétés, qui comportent des surfaces de reconnaissance leur permettant d’établir des interactions spécifiques. Les résultats de cette étude, dirigée par des scientifiques du Centre d'élaboration de matériaux et d'études structurales1 (CEMES) et de l'Institut de biologie intégrative de la cellule2 (I2BC), sont publiés dans la revue Proceedings of the National Academy of Science (PNAS).
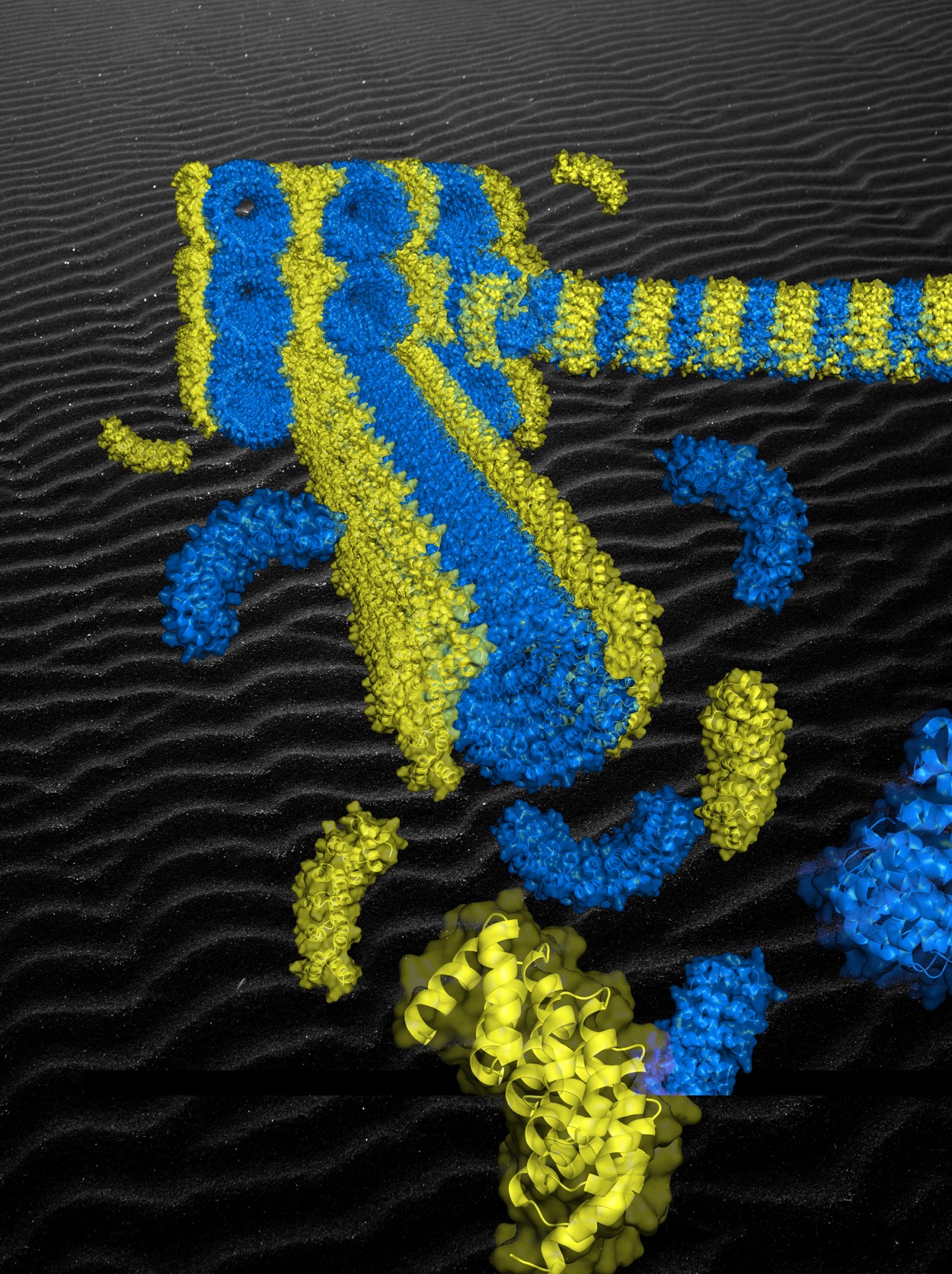
@ I2BC, CEMES, CBI, IPR et ICB
S’il est possible de construire des nanostructures de forme contrôlée en exploitant la structure en double hélice des molécules d’ADN (conduisant à des assemblages communément appelés "origamis d'ADN"), il demeure beaucoup plus difficile d'élaborer de telles structures précises à partir de protéines. Pourtant, dans les cellules vivantes, des architectures supramoléculaires très sophistiquées comme les microtubules, les filaments d’actine, ou les flagelles assurent des fonctions vitales et sont entièrement constituées de protéines naturelles. Ces dernières s'assemblent spontanément parce que chaque protéine a une forme particulière qui lui permet d’interagir de façon très spécifique avec d’autres protéines, menant ainsi à des architectures complexes. Créer des architectures supramoléculaires ordonnées de protéines ouvrirait la porte à de nombreuses applications en biologie mais aussi en science des matériaux.
Une méthode généralisable de construction d'architectures de protéines artificielles a été élaborée dans le cadre d'un travail interdisciplinaire réunissant des biochimistes et de physico-chimistes du Centre d'élaboration de matériaux et d'études structurales (CEMES), de l'Institut de biologie intégrative de la cellule (I2BC), de l'Institut de physique de Rennes3 (IPR), du Centre de biologie intégrative4 (CBI) et du laboratoire interdisciplinaire Carnot de Bourgogne5 (ICB). Plutôt que de modifier des protéines naturelles, les scientifiques ont privilégié la conception de nouvelles protéines à la fois très régulières et programmées pour s'assembler dans des géométries précises capables de former des superstructures stables. L'une de ces protéines, dite « agrafe », a pour rôle d'agencer précisément plusieurs autres protéines appelées « briques ». Leur assemblage donne naturellement à l'architecture tridimensionnelle supramoléculaire sa complexité structurale. Un premier défi a donc été de concevoir ces protéines et de les produire. Ensuite, en combinant plusieurs techniques, dont la diffusion X et la cryomicroscopie électronique, les scientifiques ont montré ainsi que les protéines s'assemblent en quelques minutes, à température ambiante et suivant l'architecture prévue. Ceci constitue une première expérimentale dont le principe est généralisable à d’autres systèmes moléculaires.
Ce concept d'origami de protéines promet une programmation des architectures aussi efficace que les origamis d'ADN, mais avec en plus le potentiel de généralisation important qu’apporte l’extraordinaire diversité des protéines en termes de fonctions chimiques et de reconnaissance moléculaire. En particulier, faire varier l’agencement spatial des briques et des agrafes pourra permettre de créer toute une gamme de « patrons » pour par exemple organiser des nanoobjets les uns par rapport aux autres (enzymes, nanoparticules, virus, …), encapsuler des principes actifs, guider la croissance de nanomatériaux ou encore structurer l'interface entre la matière biologique et un matériau solide. Ce premier travail expérimental ouvre donc des perspectives importantes, de plus au moment favorable où les outils informatiques de conception de protéines artificielles deviennent performants et disponibles.
Bibliographie
Design, synthesis, and characterization of protein origami based on self-assembly of a brick and staple artificial protein pair. L. Moreaud et al., PNAS, paru le 09 mars 2023
DOI : 10.1073/pnas.2218428120
Archives ouvertes HAL